| << HOME |
|
1. Wstęp
Awidyna jest główną glikoproteiną występującą w części białkowej jaj ptaków, płazów i gadów [MP98]. Pomimo tego, że stanowi tylko 0,05% zawartości białek w białku jaja kurzego, traktowana jest jako substancja antyodżywcza. Nie zaleca się stosowania diety bogatej w surowe białko jaj, gdyż zawarta w nim awidyna łączy się w jelicie z biotyną (witamina H od niem. Haut - skóra; rys. 1) i przeciwdziała jej wchłanianiu, co może prowadzić do niedoboru tej witaminy w organizmie [Vi76]. Biotyna jest niezbędna nie tylko dla człowieka, ale także dla rozwoju drobnoustrojów, dlatego występująca w jaju awidyna stanowi jego naturalną ochronę przeciwbakteryjną [Pi98]. Obróbka cieplna unieczynnia awidynę, dlatego białko jaj gotowanych nie przeszkadza w absorpcji biotyny [Vi76]. W białku jaja oprócz awidyny występują też m.in. owomukoid, owomucyna i lizozym. Składniki te można rozdzielić na drodze elektroforezy, poprzez proces frakcjonowanego wysolenia oraz metodą chromatografii [WK68].
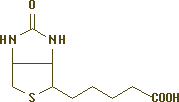
2. Charakterystyka awidyny i jej kompleksu z biotyną
Awidyna należy do rodziny białek zwanych glikoproteinami i jako jedyne białko jaja jest nukleoproteiną, tzn. że w swojej cząsteczce zawiera kwasy nukleinowe [Pi98]. Składniki sacharydowe wiążą się wiązaniem amidowym z resztą asparaginy każdej podjednostki awidyny. Fragmenty cukrowe złożone są z czterech cząsteczek N-acetyloglukozaminy i pięciu cząsteczek mannozy. Cząsteczka awidyny jest oligomerem złożonym z czterech łańcuchów polipeptydowych nie związanych wiązaniami kowalencyjnymi, skręconych w kształcie ósemki. Każdy taki łańcuch zawiera jeden mostek disulfidowy i 128 reszt aminokwasów, Ala1-> Glu128, z których 15 pozycji jest identycznych jak w przypadku lizozymu, co stanowi 12% całkowitego składu aminokwasowego awidyny [BG85]. Taki oligomer ma masę 68,3kDa i punkt izoelektryczny przy pH równym 10 [Si88]. Białko to bardzo dobrze rozpuszcza się w wodzie i roztworach soli, a krystalizuje ze stężonych roztworów soli między pH 5 a 7 [Gr75]. Awidyna została wyizolowana w trzech różnych formach [WK68]. Awidyna jest niestabilna w warunkach utleniających, szczególnie podczas silnego oświetlania, co może być spowodowane obecnością niezwykle reaktywnej reszty tryptofanu po stronie wiążącej białka. Miejsce wiązania biotyny znajduje się wewnątrz cylindra utworzonego przez reszty aminokwasów jednej podjednostki i pętle pochodzące od sąsiednich podjednostek tego białka [Gr75; Na98].
Kompleks awidyny z biotyną występuje w szerokim zakresie pH (2÷10,5), natomiast w bardzo kwaśnym i w silnie alkalicznym środowisku następuje denaturacja awidyny, prowadząca do jej dysocjacji na podjednostki [Si96]. Stała dysocjacji kompleksu awidyna - biotyna przy pH 5,0 jest najniższa i wynosi k-1/k1=1,3×10-15M. Zmiana energii swobodnej kompleksu DG wynosi -85kJ/M, a zmiana entalpii układu DH to -90kJ/M [BG85]. Wiązanie z biotyną rozpada się również w procesie sterylizacji, w temperaturze 120°C przez około 15 minut przy obecności soli. Przy braku soli uwolnienie 88% biotyny z kompleksu następuje po 10 minutach ogrzewania w temperaturze 100°C [Gr75; Si96]. Awidyna aktywnie wiąże biotynę tylko wtedy, gdy występuje w surowym jaju, natomiast jej zdolność do wiązania biotyny zanika po ugotowaniu jaja, a nawet już w 85°C. Niestety, kompleks białko-witamina jest odporny na działanie trypsyny, chymotrypsyny, pankreatyny i pronazy [Si96].
3. Skutki wiązania witaminy H przez awidynę
Wiązanie biotyny przez awidynę powoduje całkowite zahamowanie wchłaniania tej witaminy przez organizm. Niedobory witaminy H prowadzą do takich zmian chorobowych jak: zapalenie skóry i języka (zanik brodawek), łojotok, wypadanie włosów, niedokrwistość, podwyższenie poziomu cholesterolu, depresja, apatia, senność, stany lękowe, halucynacje, bóle mięśni, nadwrażliwość czuciowa, utrata łaknienia i ogólne osłabienie. Przy przedłużającej się awitaminozie biotynowej skóra przybiera szarobiałą barwę i zaczyna się łuszczyć [Ka96; MP98; Mu95; PIM; WIEM]. Dzienne zapotrzebowanie człowieka na biotynę wynosi około 100mg na dobę, wartość ta jednak wzrasta przy spożywaniu surowych jaj, a leczenie niedoboru wymaga podawania 100÷200µg na dobę [Dr96]. Prowadzono doświadczenia mające na celu sprawdzenie wpływu zawartości biotyny w diecie na stan zdrowia szczurów (rys. 2). Zwierzęta hodowane na diecie ubogiej w biotynę i z dodatkiem surowego białka jaja kurzego wykazywały cechy charakterystyczne dla niedoboru biotyny: zahamowanie wzrostu, zapalenie skóry i utratę sierści. Objawy te jednak ustąpiły po trzech miesiącach karmienia pokarmem bogatym w biotynę - można było zaobserwować normalny wzrost i wyleczone zapalenie skóry.
U człowieka niedobór biotyny występuje rzadko. Przypadek taki zaobserwowano u człowieka, który żywił się tylko surowymi jajami i winem, jednak objawy choroby ustąpiły po podaniu mu biotyny [Vi76].
4. Awidyna jako inhibitor w reakcjach biochemicznych zachodzących z udziałem biotyny
Witaminy grupy B stanowią składniki koenzymów i umożliwiają prawidłowy przebieg procesów metabolicznych węglowodanów, tłuszczów i białek. W przemianach zachodzących z udziałem biotyny, jej grupa karboksylowa łączy się wiązaniem amidowym z grupą epsilon-aminową reszty lizyny wchodzącej w skład enzymu. Enzymy te to karboksylazy wymagające ATP jako źródła energii do utworzenia nowego wiązania -C-C- [St97; WIEM]. W procesie glukoneogenezy biotyna, będąc grupą prostetyczną karboksylazy, służy jako przenośnik aktywowanego CO2, w wyniku czego z pirogronianu powstaje szczawiooctan. Powstawanie glukozy z pirogronianu czy szczawiooctanu jest zablokowane po dodaniu do homogenatu komórkowego awidyny. Białko to jest bowiem bardzo specyficznym inhibitorem enzymów zawierających biotynę jako grupę prostetyczną. Inhibicja ta polega na związaniu biotyny z hydrofobowym miejscem awidyny.
W ten sam sposób hamowana jest reakcja otrzymywania malonylo-CoA w procesie biosyntezy kwasów tłuszczowych. Biotyna bierze udział w nieodwracalnej reakcji powstawania malonylo-CoA z acetylo-CoA, katalizowanej przez karboksylazę acetylo-CoA.
Biotyna jest też koenzymem w rozkładzie leucyny. Karboksylacja beta-metylokrotonylo-CoA do beta-metyloglutakonylo-CoA przebiega według bardzo podobnego mechanizmu jak wyżej wymienione reakcje, zachodzące podczas glukoneogenezy i biosyntezy kwasów tłuszczowych [Gu98; Ka96; St97].
5. Zastosowanie awidyny w różnych metodach i technikach badawczych
5.1 Metoda izotopowych rozcieńczeń - oznaczanie biotyny
Awidyna, silny antagonista biotyny, jest wykorzystywana do jej oznaczania metodą izotopowych rozcieńczeń, po uprzednim uwolnieniu jej z połączeń z białkami. Tą bardzo czułą metodą można oznaczyć biotynę w zakresie stężeń od kilku do kilkudziesięciu pikomoli (10-12 mola) [MP98].
5.2 Technika Western Blot (białko - przeciwciało)
Po rozdzieleniu białek metodą elektroforezy SDS/PAGE, ich renaturacji i przeniesieniu na błonę nitrocelulozową (blotting) inkubuje się je z przeciwciałami specyficznymi dla określonego białka. Są to najczęściej przeciwciała drugorzędowe, dla których antygenem jest przeciwciało specyficzne. Do detekcji używa się zwykle barwników fluorescencyjnych, koloidalnych roztworów złota lub enzymów. Drugorzędowe przeciwciała mogą być skoniugowane z enzymem, np. fosfatazą alkaliczną (AP), oksydazą glukozową (GO) lub peroksydazą chrzanową (HRP). Produkt reakcji przeprowadzanej przez ten enzym jest barwny. Innym systemem detekcji jest awidyna lub streptawidyna skoniugowana z enzymem (AP lub HRP) [BB94; Na98; Now].
5.2.1 Reakcja przy użyciu układu biotyna - awidyna
Pośrednią metodę immunoenzymatyczną opartą na wysokim powinowactwie biotyny do awidyny wykorzystuje się jako metodę jakościową do wykrywania obecności antygenów tkankowych. Można wyróżnić dwie odmiany tej metody: reakcję ABC (Avidin - Biotynylated peroxidase Complex) oraz reakcję LAB (Labelled Avidin - Biotin). W obu tych reakcjach zamiast awidyny można stosować wyizolowaną ze szczepu Streptomyces avidinii streptawidynę.
Reakcja ABC zachodzi w trzech etapach: 1) reakcja między antygenem tkankowym a przeciwciałem pierwotnym z utworzeniem kompleksu, 2) reakcja powstałego kompleksu z przeciwciałem wtórnym biotynylowanym swoistym dla przeciwciała pierwotnego, 3) reakcja kompleksu antygen tkankowy - przeciwciało pierwotne - przeciwciało wtórne z kompleksem awidyna - biotynylowana peroksydaza (ABC), który ma zdolność łączenia się z biotyną związaną z przeciwciałem wtórnym. Przebieg tej reakcji ocenia się na podstawie aktywności peroksydazy w reakcji enzymatycznej. Reakcja LAB jest bardziej czuła i dużo szybsza w wykonaniu niż reakcja ABC. Polega ona na wiązaniu biotynylowanego przeciwciała wtórnego z wyznakowaną enzymem awidyną [BB94; Na98].
6. Zakończenie
Istnienie awidyny, będącej specyficzną antywitaminą, powoduje, że do diety stosuje się pewne ograniczenia. Dotyczą one między innymi spożywania surowego białka jaja, np. pod postacią kogla-mogla. Problem awitaminozy biotynowej spowodowany jest nie tylko obecnością awidyny, ale jest też skutkiem zniszczenia flory bakteryjnej w jelitach, np. po leczeniu antybiotykami [WIEM]. Częściej niedobory biotyny można zauważyć u indyków, kurcząt i świń. U trzody np. można zaobserwować zapalenie skóry połączone z wypadaniem szczeciny: na uszach, szyi, łopatce i ogonie [Pa98]. Także u najlepszych przyjaciół człowieka, czyli u psów, niedobory witaminy H powodują przykre zmiany skórne. W większości podręczników, dotyczących hodowli tak psów, jak i kotów, można doczytać się wręcz zakazu podawania tym zwierzętom surowego białka jaja [Ta94; Ta95].
7. Piśmiennictwo
|
|
/ Aleksandra Kramarska, 2000 |